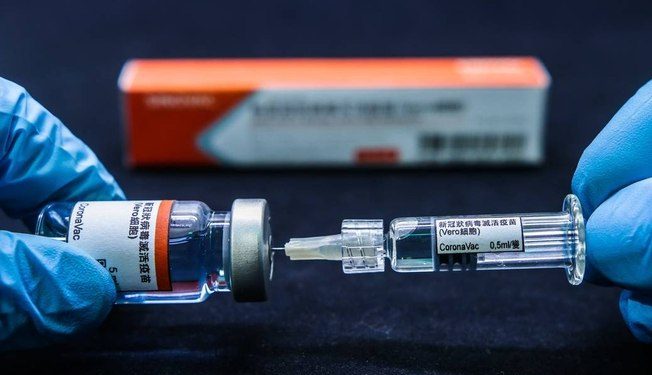
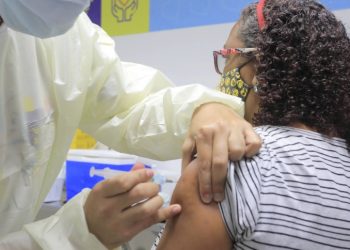
O Instituto Butantan oficializou hoje o pedido de uso emergencial da CoronaVac, vacina contra Covid-19, à Anvisa (Agência Nacional de Vigilância Sanitária). O órgão prevê que a análise do pedido emergencial leve até dez dias. Caso seja aprovado, a imunização de grupos de risco como idosos e profissionais da saúde estará autorizada.
A submissão — como é chamado oficialmente o pedido — foi a primeira para vacinação contra o novo coronavírus no Brasil. Segundo o Butantan, a solicitação foi feita às 9h34. Ontem, o instituto disse que a eficácia da vacina é de 78% para casos leves (leia mais abaixo). Há expectativa de que a Fiocruz (Fundação Oswaldo Cruz) também faça hoje um pedido de uso emergencial da vacina desenvolvida pela Universidade de Oxford em parceria com o laboratório Astrazeneca.
Em nota, a Anvisa explicou detalhes do processo, dizendo que as primeiras 24 horas serão de triagem dos documentos apresentados pelo Butantan. “Se houver informação importante faltando, a Anvisa pode pausar o prazo e solicitar as informações adicionais ao laboratório”, diz a nota (veja abaixo na íntegra).
Segundo a agência, foi feito apenas o pedido para uso emergencial. O Butantan não solicitou o registro da vacina, que é uma autorização definitiva para imunização em massa e comercialização com bula.
No ano passado, foi aprovada uma lei que determina prazo de 72 horas para Anvisa aprovar o registro de fármacos (entre eles vacina) desde que já aprovados em agências regulatórias de referência.
Mas a lei vale para vacinas que estejam registradas (para uso em massa) nas agências dos Estados Unidos, União Europeia, Japão ou da China. Até hoje, nenhuma vacina está aprovada nesta condição em nenhuma destas agências. A aprovação nestes países é em caráter emergencial. Por isso, a Anvisa trabalha com prazo de aprovação de dez dias, que foi definido em protocolo interno da agência.
Ontem, o Brasil registrou 200 mil mortes pelo novo coronavírus. Os dados foram divulgados pelo consórcio de veículos de imprensa, do qual o UOL faz parte.
Início da vacinação
Também ontem, o ministro da Saúde, general Eduardo Pazuello, afirmou que a vacinação no Brasil deve começar em 20 de janeiro na “melhor das hipóteses” ou no máximo até o fim de março em caso de eventuais problemas. A expectativa é que sejam usados os imunizantes produzidos pela Fiocruz e pelo Butantan.
Em São Paulo, o governador João Doria (PSDB) prometeu o início da vacinação a partir de 25 de janeiro, com a CoronaVac. Pelo plano apresentado os primeiros a serem imunizados serão trabalhadores de saúde, indígenas e quilombolas. Em seguida, idosos de 75 anos ou mais. As fases são escalonadas por faixa etária entre os mais velhos.
Há consenso entre os médicos do Centro de Contingência ao Coronavírus do governo paulista e da Secretaria Municipal de Saúde de que é preciso aumentar as restrições de quarentena em São Paulo, para que as contaminações por Covid-19 diminuam. O objetivo é também para garantir que haja leitos disponíveis daqui a 15 dias, quando parte das pessoas que se infectaram em aglomerações nas festas de final de ano podem desenvolver quadros graves e demandar internações.
A Prefeitura de São Paulo e o governo estadual vão decidir em uma reunião antes do anúncio sobre a atualização do Plano São Paulo, no início da tarde de hoje, se a capital paulista vai regredir à fase laranja ou se continua na fase amarela, mas com uma extensão das restrições.
Índices de eficácia
Ontem, o governo de São Paulo apresentou os resultados da terceira fase de teste do imunizante. Segundo o Butantan, a eficácia é de 78% para casos leves de Covid-19 e 100% em casos graves. A porcentagem está acima dos 50% exigidos pela Anvisa.
As porcentagens de eficácia da CoronaVac, segundo o Butantan, são as seguintes:
• contra casos leves de Covid-19: 78%
• contra casos moderados de Covid-19: 100%
• contra casos graves de Covid-19: 100%
Os números acima mostram que a cada 100 pessoas vacinadas, 22 desenvolveram sintomas leves do coronavírus e podem ter recorrido a atendimento ambulatorial, afirma o instituto. No entanto, nenhum dos voluntários chegou a desenvolver sintomas moderados ou graves, que poderiam levar a internação ou morte.
Veja a nota na íntegra da Anvisa
“A Anvisa recebeu nesta sexta-feira (8/1) o pedido de autorização temporária de uso emergencial, em caráter experimental da vacina Coronavac. O pedido foi enviado pelo Instituto Butantan, que no Brasil conduz os estudos da vacina desenvolvida pela empresa Sinovac.
A Anvisa já iniciou a triagem dos documentos presentes na solicitação e da proposta de uso emergencial que o laboratório pretende fazer.
As primeiras 24h serão utilizadas para fazer uma triagem do processo e checar se todos os documentos necessários estão disponíveis. Se houver informação importante faltando, a Anvisa pode pausar o prazo e solicitar as informações adicionais ao laboratório.
Para fazer sua avaliação, a Anvisa vai utilizar as informações apresentadas junto com o pedido e também as informações já analisadas pela Anvisa por meio da Submissão Contínua. A análise do pedido de uso emergencial é feita por uma equipe multidisciplinar, envolve especialista das áreas de registro, monitoramento e inspeção. A equipe vem atuando de forma integrada, com as ações otimizadas e acompanhadas pela Comissão que envolve 3 Diretorias da Agência.
A meta da Anvisa é fazer a análise do uso emergencial em até 10 dias, descontando eventual tempo que o processo possa ficar pendente de informações, a serem apresentadas pelo laboratório.
Por fim, a Anvisa atua, conforme os procedimentos científicos e regulatórios, os quais devem ser seguidos por aqueles que buscam o a autorização de vacinas para serem utilizadas na população brasileira.”
Fonte: UOL