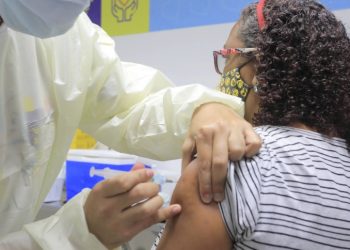
A Anvisa (Agência Nacional de Vigilância Sanitária) informou que está prevista para o próximo domingo (17) a decisão da diretoria colegiada do órgão sobre os pedidos de autorização emergencial das vacinas contra o novo coronavírus.
Foram submetidas para análise na última sexta-feira (8) a vacina CoronaVac, do Instituto Butantan em parceria com o laboratório Sinovac, e a da Fiocruz (Fundação Oswaldo Cruz), desenvolvida em parceria com a Universidade de Oxford e o laboratório AstraZeneca.
A data representa o penúltimo dos dez dias estabelecidos para análise. “Para tanto, faz-se necessária a entrega, em tempo hábil para análise, dos documentos faltantes e complementares”, explica a Anvisa em nota.
No último sábado, a Anvisa informou que o pedido de vacinação emergencial da Fiocruz apresentou os “documentos preliminares e essenciais para a avaliação detalhada da Agência”. Mas pediu que o Butantan envie documentação que já era prevista e não foi entregue.
No domingo, o Butantan começou a enviar a documentação pendente, mas, até o momento, 5,47% da documentação ainda não foi apresentada, segundo site de monitoramento lançado pela agência. Até as 19h20 de hoje, 40,7% da análise já fora concluída, e 33,7% estava pendente de complementação. Outros 20,13% ainda estavam sendo estudados.
Entre os conteúdos pendentes, está o relatório de imunogenicidade, que é a capacidade de uma substância provocar uma resposta imune. No site da Anvisa, o documento aparece como “não enviado”.
Já no caso do pedido apresentado pela Fiocruz, não há informação de relatórios que ainda não foram enviados. Até o momento, 32,39% da análise já foi concluída, e outros 53,17% estão em análise.
CoronaVac
Em nota, o Instituto Butantan informou ter feito uma “força-tarefa” para apresentar os dados solicitados. “Toda a documentação será entregue ainda nesta semana. O fato de a Anvisa solicitar mais informações, que estão sendo prontamente atendidas pelo Butantan, não afeta o prazo previsto para autorização de uso do imunobiológico. Os pedidos de novos documentos ou mais informações são absolutamente comuns em processos como esses”, diz o texto.
O governo paulista precisa da autorização da Anvisa para realizar seu plano estadual de imunização, cuja primeira fase está prevista para começar no próximo dia 25 de janeiro.
Após divulgar taxas de eficácia parciais da CoronaVac de 78% na semana passada, o Governo de São Paulo revelou hoje que a eficácia geral da vacina, que engloba todos os grupos analisados nos testes clínicos, é de 50,38%. O resultado era muito aguardado para avaliar de forma mais completa a vacina contra a covid-19 do Instituto Butantan em parceria com o laboratório chinês Sinovac.
O número já era esperado, numa previsão de que a eficácia geral ficasse entre 50% e 60%. Como o mínimo exigido para a aprovação pela Anvisa é de 50%, o número de 50,38% está dentro do aceitável e também atende aos padrões da OMS (Organização Mundial da Saúde). Os pesquisadores afirmam que 0,3% dos voluntários apresentaram reações alérgicas e não foram registrados efeitos adversos mais graves.
Vacina da Fiocruz
Serão importadas 2 milhões de doses prontas da vacina de Oxford/AstraZeneca da Índia. A previsão é que as doses deixarão a Índia no dia 20, mas o objetivo é antecipar essa data.
A presidente da Fiocruz, Nísia Trindade Lima, afirmou na última sexta que a vacina de Oxford/AstraZeneca contra a covid-19 deve começar a ser aplicada cinco dias após chegar ao Brasil. A declaração foi dada em entrevista à GloboNews.
“[Depois que as doses chegarem da Índia], a vacina passa por um processo de rotulagem que leva em torno de um dia. A distribuição é pelo PNI (Plano Nacional de Imunização), que precisa de três a quatro dias”, afirmou Nísia. “Então, da chegada das doses ao processo de distribuição e início da vacinação, demora um período de cinco dias”.
A vacina Oxford/AstraZeneca está sendo importada do Instituto Serum, fabricante indiano contratado para produzir 1 bilhão de doses do imunizante a países em desenvolvimento.
Fonte: UOL